注意了!出口防疫物資特別事項來了
出口申報最新要求
根據商務部、海關總署、國家藥品監督管理局2020年第5號《關于有序開展醫療物資出口的公告》,在疫情防控特殊時期,為有效支持全球抗擊疫情,保證產品質量安全、規范出口秩序,自4月1日起,出口新型冠狀病毒檢測試劑、醫用口罩、醫用防護服、呼吸機、紅外體溫計的企業向海關報關時,需提供書面或電子聲明,承諾出口產品已取得我國醫療器械產品注冊證書,符合進口國(地區)的質量標準要求。海關憑藥品監督管理部門批準的醫療器械產品注冊證書驗放。
即出口屬于醫療器械管理的防疫物資,從4月1日起,企業需提供資質證明文件。出口其他防疫物資,海關無特殊資質要求。
我國相關醫療器械產品注冊信息可前往國家藥監局網站查詢
www.nmpa.gov.cn

海關監管
為進一步加強新冠肺炎疫情期間出口防疫物資質量安全監管,避免出口不合格防疫物資,海關近期在貨物貿易渠道,開展了出口口罩、防護服、護目鏡、手套、呼吸機等防疫物資質量安全監管專項工作。
對存在質量安全問題的出口防疫物資依法依規實施快速處置,對發現企業有出口防疫物資偽瞞報、夾藏夾帶、摻雜摻假、以假充真、以次充好或者以不合格冒充合格等違法行為的,將嚴格依法依規進行處理。

產品國外準入要求
生產企業需確保出口的防疫物資質量符合進口國(地區)的要求及認證。
以下列出主要國外防疫物資技術要求供出口企業參考,具體內容及相關變化情況以相關管理部門、國外官方機構最新公布為準。
▼▼▼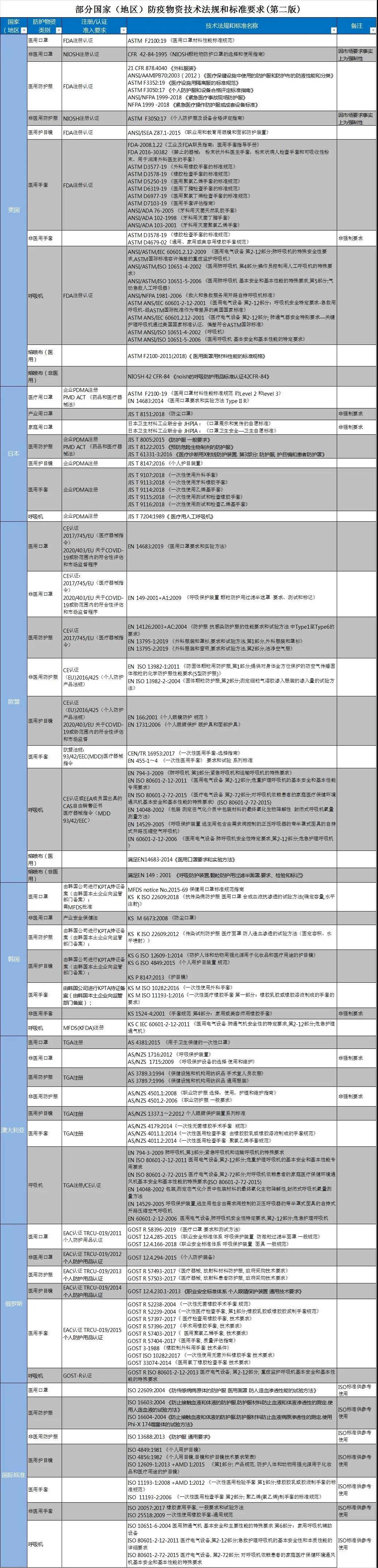
以上表格可前往海關總署商品檢驗司網站下載鏈接
http://sjs.customs.gov.cn/sjs/resource/cms/article/2691636/2942496/2020033117030751981.xlsx

1.近期歐美等國家地區陸續發布防疫物資監管的臨時或緊急措施,放寬部分防疫物資準入要求,如歐盟委員會3月13日發布《關于COVID-19疫情期間的合格評定和市場監督程序的(EU)2020/403號建議》,提出正在進行認證程序的產品,只要達到歐盟技術法規要求,可在一定期限內在歐盟市場上銷售,但要確保認證工作會繼續完成。歐盟成員國官方或授權機構可以采購沒有CE標志的防護產品供醫護人員使用,但不能進入常規銷售渠道并提供給其他使用者。
4月3日,美國FDA在其官網上專門發布針對中國生產的未獲NIOSH認證的呼吸器(口罩)獲得EUA授權的文件。美國FDA曾經將中國標準的KN95口罩排除在EUA授權范圍之外,這一新發布的文件,標志著按照中國標準生產的KN95口罩得到美國官方的正式認可。
疫情期間,歐美放寬了一些必要準入條件,但均為應急措施或應急建議,實質并未放松具體技術要求,且同時強調了市場抽查和處罰的后續監管力度。同時,建議和意見不具備任何法律約束效力,僅供成員國和監管機構參考。因此,為防范和降低風險,我國企業仍需嚴格按照目的地國家的技術要求和合規評定要求進行生產經營,建議完成相關認證后再行出口。
2.歐盟醫療器械法規MDR(EU 2017/745)于2017年5月25日正式生效,與舊的醫療器械指令MDD(93/42/EEC)交替使用過渡期為三年。因此,按照舊的醫療器械指令MDD(93/42/EEC)所獲CE認證的口罩等醫療器械產品,需面臨換版問題。對已經在歐盟渠道正式上市的產品,MDD(93/42/EEC)指令CE證書可以保持到2024年5月26日,今年5月26日前未能上市的產品,原則上應將舊的MDD證書重新申請調整到MDR版本。MDR的審核流程和要求更為復雜繁瑣,認證周期更長,企業應引起注意。